Nas reações químicas, as substâncias reagem entre si originando produtos em proporções específicas. Desse modo, é possível calcular quanto de produto será formado, ou o rendimento da reação. Se quisermos determinado rendimento, podemos também calcular quanto deverá ser utilizado de reagente.
Por meio dos cálculos estequiométricos é possível fazer essas e outras relações específicas. Mas, antes de tudo, precisamos conhecer as proporções existentes entre os elementos que formam as diferentes substâncias. E essas proporções são dadas pelas fórmulas moleculares, percentuais e mínimas ou empíricas.
Além disso, a base dos coeficientes de qualquer reação são as leis ponderais:
- Lei da conservação da massa– Num sistema fechado, a massa total dos reagentes é igual à massa total dos produtos;
- Lei das proporções constantes– Toda substância apresenta uma proporção em massa constante na sua composição.
Além disso, a lei volumétrica de Gay-Lussac também nos fornece uma importante informação: se a pressão e a temperatura não mudarem, os volumes dos gases participantes de uma reação têm entre si uma relação de números inteiros e pequenos.Usa-se nos cálculos estequiométricos a relação mostrada abaixo:
1 mol ↔ 6. 1023 moléculas ou fórmulas unitárias ↔ massa molar em g/mol ↔ 22,4 L (nas CNTP*)
|
*Condições Normais de Temperatura e Pressão.
Vejamos um exemplo de cálculo estequiométrico em que se relacionará apenas quantidade de matéria (mols).
Exemplo:Qual a quantidade de matéria de álcool etílico, C2H6O(l), que deve reagir para fornecer 12 mols de gás carbônico? Considere esta uma reação de combustão completa.
Equação Balanceada:
C2H6O(l) + 3 O2(g) → 2CO2(g) + 3 H2O(v)
Observe que 1 mol de álcool produz 2 mols de gás carbônico, assim pode-se fazer uma regra de três simples para resolver o problema:
1 mol ------------------- 2 mols
x-------------------------12 mols
X=6 mols
Resposta: 6 mols de álcool etílico são necessários para gerar 12 mols de gás carbônico.
Lembre-se que é possível relacionar também massa, número de moléculas e volume molar. Porém, em todos esses casos é necessário seguir as seguintes regras fundamentais:
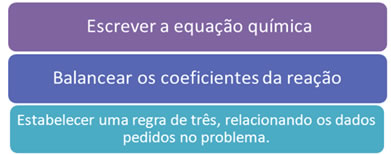
Regras fundamentais de qualquer cálculo estequiométrico.
Fonte: Brasil Escola

Nenhum comentário:
Postar um comentário